Dirigée par Isabelle MARTY
Mots clés
Thèmes de recherche
L’équipe « Myologie cellulaire et Pathologies » a développé un réseau de recherche bioclinique permettant des interactions fortes entre recherches fondamentale et clinique en lien avec des maladies rares liées à des défauts de la contraction musculaire.
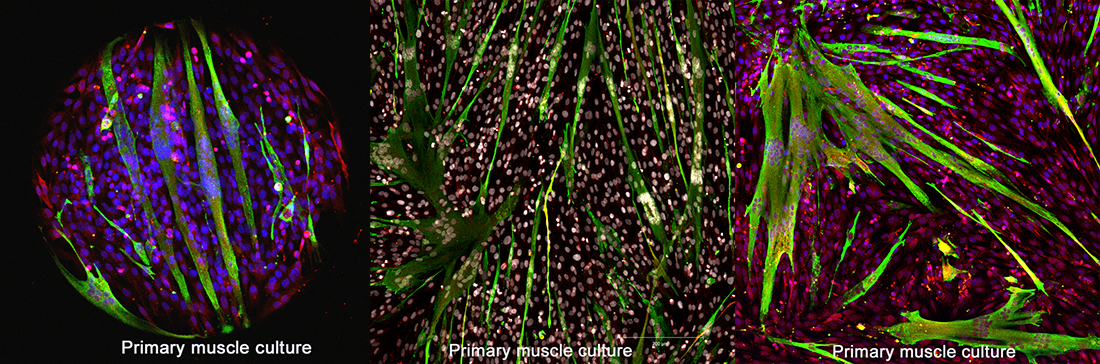
Le fonctionnement correct du muscle nécessite un couplage entre l’activité électrique, engendrée par la stimulation nerveuse, et l’activité contractile du muscle : en réponse à la stimulation électrique, le muscle répond par une libération massive de calcium intracellulaire qui provoque alors la contraction du muscle. Cette libération de calcium se fait par un ensemble de protéines organisées autour du récepteur de la ryanodine et de la triadine, constituant le « complexe de relâchement du calcium ». Ce complexe est localisé spécifiquement dans un compartiment très spécialisé du muscle, les triades. Le complexe de relâchement du calcium est la cible de nombreuses mutations génétiques conduisant aux différentes pathologies musculaires étudiées par l’équipe (Central Core Disease - CCD, Multimini Core Disease - MmD, Hyperthermie maligne, ...) La compréhension du fonctionnement de ce complexe et des mécanismes cellulaires impliqués dans son trafic intracellulaire est cruciale pour développer de nouveaux traitements.
L'équipe « Myologie cellulaire et Pathologies » étudie le fonctionnement normal ou pathologique de ce complexe, ouvrant ainsi de nouvelles perspectives thérapeutiques. L’équipe, qui regroupe des chercheurs fondamentaux et des généticiens, a développé un réseau de recherche bioclinique basé sur des interactions fortes entre recherche fondamentale et recherche clinique pour les maladies rares liées à des défauts des relâchements de calcium musculaire.
Afin de caractériser les fonctions et la mise en place intracellulaire d’un complexe protéique essentiel pour la contraction musculaire, l’équipe « Myologie cellulaire et Pathologies » développe les projets de recherches suivants :
- Développement et caractérisation de modèles cellulaires ou animaux : comprendre la fonction des protéines du complexe, comprendre les pathologies liées à leurs anomalies.
- Développement thérapeutique : développer des traitements permettant de corriger les mutations génétiques à l’origine de maladies rares, dont les mutations du récepteur de la ryanodine et de la triadine.
- Trafic intracellulaire : étudier le rôle des protéines du complexe de relâchement du calcium dans le maintien ou la mise en place du complexe et plus globalement des triades, en interaction avec d'autres partenaires, tels les microtubules.
Techniques utilisées :
- Biologie cellulaire et moléculaire : Clonage, transfection, production de vecteurs viraux, transduction virale, production et culture de cellules musculaires (cultures primaires) humaines et murines, transduction in vivo.
- Biochimie : Western blot, immunofluorescence, immunoprécipitation.
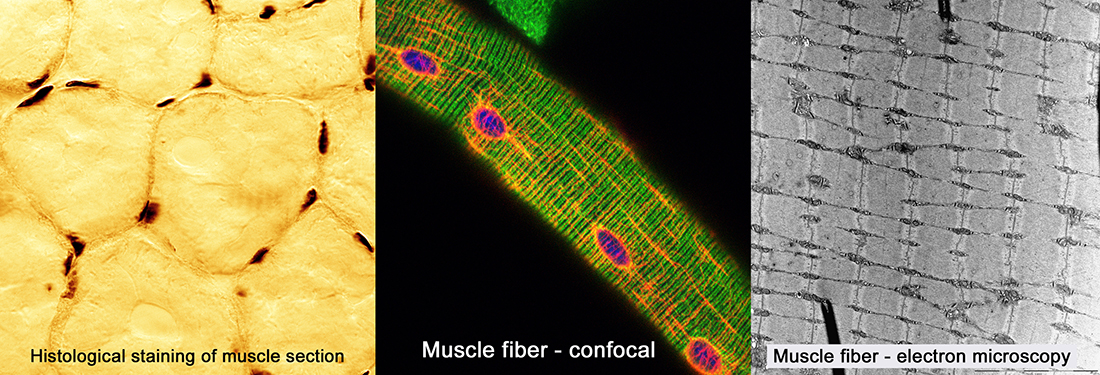
- Microscopie confocale et électronique : Marquages immunologiques, analyse morphologique en microscopie électronique, imagerie calcique, FRAP, photoactivation.
Site Web de l'équipe
Partenaires : 
Thèses de l'équipe
Publications
Beaufils M, Melka M, Brocard J, Benoit C, Debbah N, Mamchaoui K, Romero NB, Dalmas-Laurent AF, Quijano-Roy S, Fauré J, Rendu J, Marty I. (2024). Functional benefit of CRISPR/Cas9-induced allele deletion for RYR1 dominant mutation. bioRxiv
Marty I, Beaufils M, Fauré J, Rendu J. (2023). Gene therapies for RyR1-related myopathies. Curr Opin Pharmacol. 68, 102330.
Chivet M, McCluskey M, Nicot AS, Brocard J, Beaufils M, Giovannini D, Giannesini B, Poreau B, Brocard J, Humbert S, Saudou F, Fauré J, Marty I. (2023). Huntingtin regulates calcium fluxes in skeletal muscle. J Gen Physiol. 155(1), e202213103.
Beaufils M, Tourel A, Petiot A, Halmai NB, Segal DJ, Rendu J, Marty I. (2022). Development of Knock-Out Muscle Cell Lines using Lentivirus-Mediated CRISPR/Cas9 Gene Editing. J Vis Exp. 16,184.
Beaufils M, Travard L, Rendu J, Marty I. (2022). Therapies for RYR1-Related Myopathies: Where We Stand and the Perspectives. Curr Pharm Des. 28(1), 15-25.
Pelletier L, Petiot A, Brocard J, Giannesini B, Giovannini D, Sanchez C, Travard L, Chivet M, Beaufils M, Kutchukian C, Bendahan D, Metzger D, Franzini Armstrong C, Romero NB, Rendu J, Jacquemond V, Fauré J, Marty I. (2020). In vivo RyR1 reduction in muscle triggers a core-like myopathy. Acta Neuropathol Commun. 8(1), 192.
Bosson C, Rendu J, Pelletier L, Abriat A, Chatagnon A, Brocard J, Brocard J, Figarella-Branger D, Ducreux S, van Coppenolle F, Sagui E, Marty I, Roux-Buisson N, Faure J. (2020). Variations in the TRPV1 gene are associated to exertional heat stroke. J Sci Med Sport. 11, 1021-1027.
Sébastien M, Aubin P, Brocard J, Brocard J, Marty I, Fauré J. (2020). Dynamics of triadin, a muscle-specific triad protein, within sarcoplasmic reticulum subdomains. Mol Biol Cell. 31(4), 261-272.
Cacheux M, Fauconnier J, Thireau J, Osseni A, Brocard J, Roux-Buisson N, Brocard J, Fauré J, Lacampagne A, Marty I. (2020). Interplay between Triadin and Calsequestrin in the Pathogenesis of CPVT in the Mouse. Mol Ther. 28(1), 171-179.
Sébastien M, Giannesini B, Aubin P, Brocard J, Chivet M, Pietrangelo L, Boncompagni S, Bosc C, Brocard J, Rendu J, Gory-Fauré S, Andrieux A, Fourest-Lieuvin A, Fauré J, Marty I. Deletion of the microtubule-associated protein 6 (MAP6) results in skeletal muscle dysfunction. Skelet Muscle. 2018 Sep 19;8(1):30.
Osseni A, Sébastien M, Sarrault O, Baudet M, Couté Y, Fauré J, Fourest-Lieuvin A, Marty I. (2016). Triadin and CLIMP-63 form a link between triads and microtubules in muscle cells. J Cell Sci. 129(20), 3744-3755.
Cacheux M, Blum A, Sébastien M, Wozny AS, Brocard J, Mamchaoui K, Mouly V, Roux-Buisson N, Rendu J, Monnier N, Krivosic R, Allen P, Lacour A, Lunardi J, Fauré J, Marty I. (2015). Functional Characterization of a Central Core Disease RyR1 Mutation (p.Y4864H) Associated with Quantitative Defect in RyR1 Protein. J Neuromuscul Dis. 2(4), 421-432.
Marty I. (2015). Triadin regulation of the ryanodine receptor complex. J Physiol. 593, 3261-3266.
Falcone S, Roman W, Hnia K, Gache V, Didier N, Lainé J, Auradé F, Marty I, Nishino I, Charlet-Berguerand N, Romero NB, Marazzi G, Sassoon D, Laporte J, Gomes ER. (2014). N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med. 6, 1455-1475.
Dieterich K, Quijrano-Roy S, Monnier N, Zhou J, Fauré J, Avila Smirnow D, Carlier R, Laroche C, Marcorelles P, Mercier S, Mégarbané A, Odent S, Romero N, Sternberg D, Marty I, Estournet B, Jouk PS, Melki J, Lunardi J. (2013). The neuronal endopeptidase ECEL1 is associated with autosomal recessive distal arthrogryposis. Hum. Mol. Genet. 22, 1483-1492.
Rendu J, Brocard J, Denarier E, Monnier N, Pietri-Rouxel F, Beley C, Roux-Buisson N, Gilbert-Dussardier B, Perez MJ, Romero NB, Garcia L, Lunardi J, Fauré J, Fourest-Lieuvin A, Marty I. (2013) Exon skipping as a therapeutic strategy applied to a RyR1 mutation with pseudo-exon inclusion causing a severe core myopathy. Hum Gene Ther. 24, 702-713.
Fourest-Lieuvin, A., Rendu, J., Osseni, A., Pernet-Gallay, K., Rossi, D., Oddoux S., Brocard, J., Sorrentino, V., Marty, I., Fauré, J. (2012) Role of Triadin in the Organization of Reticulum Membrane at the Muscle Triad, J. Cell Science, 125, 3443-3453.
Roux-Buisson, N., Cacheux, M., Fourest-Lieuvin, A., Fauconnier, J., Brocard, J., Monnier, N., Ray, P.F., Denjoy, I., Durand, P., Guicheney, P., Kyndt, F., Leenhardt, A., Le Marec, H., Lucet, V., Mabo, P., Probst, V., Lacampagne, A., Fauré, J., Lunardi, J., Marty. I. (2012). Absence of Triadin, a Protein of the Calcium Release Complex, is Responsible for Cardiac Arrhythmia with Sudden Death in Human. Hum. Mol. Genet. 21, 2759-2767.
Oddoux S., Brocard J., Schweitzer A., Szentesi P., Giannesini B., Brocard J., Fauré J., Pernet-Gallay K., Bendahan D., Lunardi J., Csernoch L., Marty I. (2009). Triadin deletion induces impaired skeletal muscle function. J Biol Chem. 284, 34918-34929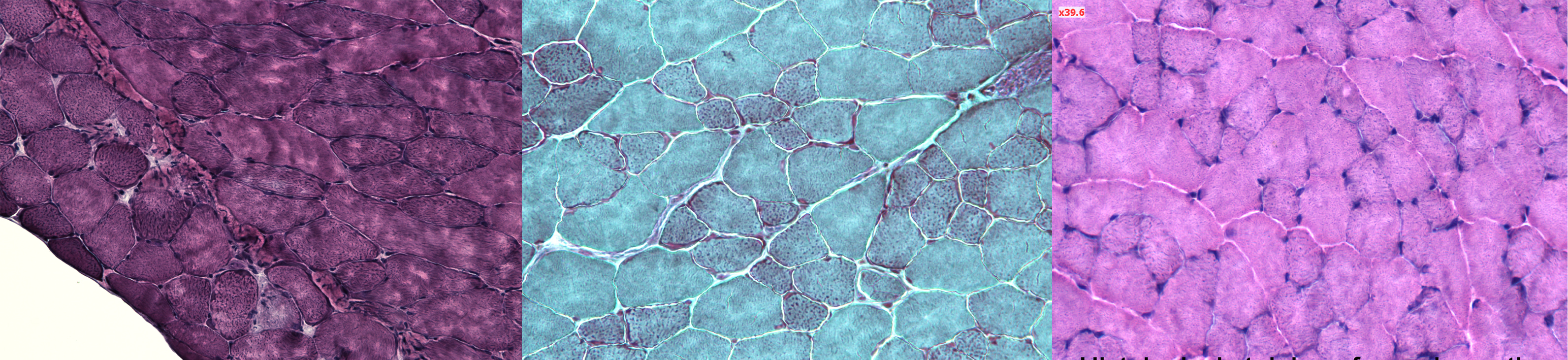
Colorations histologiques de coupes de muscle
Membres de l'équipe
- Julie BROCARD
- Clara CHARPENTIER
- Alioune FALL
- Julien FAURÉ
- Martial MALLARET
- Isabelle MARTY
- Margaux MELKA
- Patrick MERESSE
- Anne-Sophie NICOT
- Anne PETIOT
- Margaret PRAS
- John RENDU
- Robin REYNAUD DULAURIER
- Nathalie ROUX-BUISSON
- Amandine TOUREL