Dirigée par Alain BUISSON
Mots-clés
Thèmes de recherche
L’équipe « Neuropathologie et Dysfonctionnements synaptiques » développe un projet visant à caractériser les mécanismes moléculaires sous-tendant les atteintes précoces de la maladie d’Alzheimer en se focalisant sur la synapse comme première cible de la maladie.
L’équipe s’est récemment agrandie d’un groupe qui s’intéresse aux microtubules dans la synapse et à une modification particulière de la tubuline, la détyrosination.
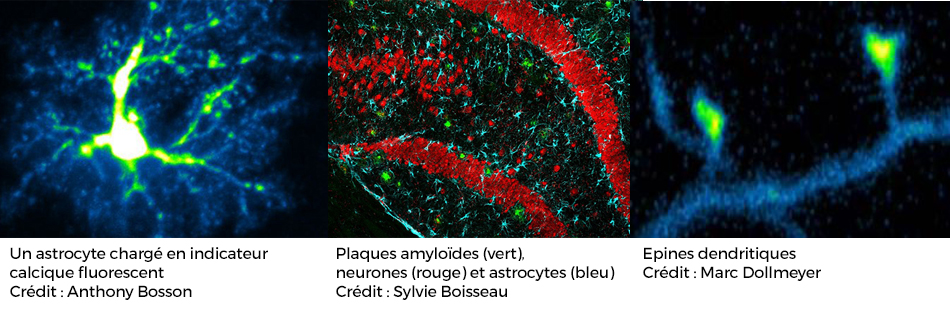
La maladie d'Alzheimer se caractérise à l’échelle cellulaire par l’accumulation de protéines à l’extérieur (protéine béta-amyloïde) et dans les neurones (protéines fibrillaires associées à l’hyperphosphorylation de la protéine Tau). De nombreuses études ont montré que la diminution du nombre des épines dendritiques (zone de contact synaptique entre neurones) apparait très tôt dans le développement de la maladie et est fortement corrélée avec les déficits cognitifs observés chez les patients (perte de mémoire notamment). L'équipe a développé des outils pour étudier les effets précoces de ces accumulations sur le fonctionnement et la structure de la synapse.
Afin de caractériser les mécanismes moléculaires conduisant à la perte de la plasticité synaptique dans la maladie d’Alzheimer, l’équipe « Neuropathologie et dysfonctionnements synaptiques » s'intéresse aux effets de l'accumulation du peptide béta-amyloïde sur le fonctionnement de la synapse et développe les projets de recherches suivants :
- Plasticité fonctionnelle des synapses glutamatergiques : caractériser les cibles intra et extracellulaires du peptide béta-amyloïde et les conséquences de son accumulation sur les dysfonctionnements pathologiques de la neurotransmission glutamatergique à l’origine de la maladie, notamment sur le fonctionnement des récepteurs NMDA.
- Plasticité structurale des synapses glutamatergiques : déterminer les effets de l'accumulation du peptide béta-amyloïde sur le cytosquelette d’actine, principal composant synaptique contrôlant la forme, l’organisation et la fonctionnalité des épines dendritiques.
- Implication des astrocytes dans ces dysfonctionnements synaptiques : étudier dans quelle mesure la communication entre astrocytes et neurones est modifiée et de quelle manière la plasticité structurale et fonctionnelle des astrocytes est liée à la perte synaptique associée à la maladie.
Techniques utilisées :
-
Physiologie : électrophysiologie et imagerie calcique sur tranches de cerveau et sur cultures de cellules
-
Biochimie et biologie cellulaire : cultures primaires de neurones et d'astrocytes, expression de protéines recombinantes, purification de synaptosomes (fractions pré- et post-synaptiques), purification de gliosomes, études d'interactions protéiques
-
Microscopie optique: microscopie confocale, FRAP
-
Lignée de souris transgéniques APP/PS1-21
Partenaires : 
Thèses de l'équipe
Publications
Publications majeures dans des revues internationales à comité de lecture
Ramirez-Rios S, Choi SR, Sanyal C, Blum TB, Bosc C, Krichen F, Denarier E, Soleilhac JM, Blot B, Janke C, Stoppin-Mellet V, Magiera MM, Arnal I, Steinmetz MO, Moutin MJ (2023). VASH1-SVBP and VASH2-SVBP generate different detyrosination profiles on microtubules. J Cell Biol, 222(2): e202205096; PMID: 36512346; doi: 10.1083/jcb.202205096.
Paumier A, Boisseau S, Jacquier-Sarlin M, Pernet-Gallay K, Buisson A, Albrieux M (2022). Astrocyte-neuron interplay is critical for Alzheimer's disease pathogenesis and is rescued by TRPA1 channel blockade Brain, 145(1): 388-405; PMID: 34302466; DOI: 10.1093/brain/awab281.
Peris L, Parato J, Qu X, Soleilhac JM, Lanté F, Kumar A, Pero ME, Martínez-Hernández J, Corrao C, Falivelli G, Payet F, Gory-Fauré S, Bosc C, Blanca Ramirez M, Sproul A, Brocard J, Di Cara B, Delagrange P, Buisson A, Goldberg Y, Moutin MJ, Bartolini F, Andrieux A (2022). Tubulin tyrosination regulates synaptic function and is disrupted in Alzheimer's disease. Brain, 145 (7): 2486-2506. PMID: 35148384; DOI: 10.1093/brain/awab436.
Sanyal C, Pietsch N, Ramirez Rios S, Peris L , Carrier L , Moutin MJ (2021) The detyrosination/re-tyrosination cycle of tubulin and its role and dysfunction in neurons and cardiomyocytes. Semin Cell Dev Biol 16;S1084-9521; DOI: 10.1016/j.semcdb.2021.12.006.
Bosson A, Paumier A, Boisseau S, Jacquier-Sarlin M, Buisson A and Albrieux M (2017). TRPA1 channels promote astrocytic Ca2+ hyperactivity and synaptic dysfunction mediated by oligomeric forms of amyloid-beta peptide. Mol Neurodegener., 12 (53): 1-19.
Frandemiche ML, De Seranno S, Rush T, Borel E., Elie A., Arnal I., Lanté F. and Buisson A. (2014). Activity dependent tau protein translocation to excitatory synapse is disrupted by exposure to Amyloid ? oligomers. J. Neurosci., 34:6084-6097
Lanté F, Toledo-Salas JC, Ondrejcak T, Rowan MJ, Ulrich D. (2011). Removal of synaptic Ca²+-permeable AMPA receptors during sleep. J Neurosci. 31:3953-61.
El Gaamouch F, Buisson A, Moustié O, Lemieux M, Labrecque S, Bontempi B, De Koninck P, Nicole O. (2012). Interaction between ?CaMKII and GluN2B controls ERK-dependent plasticity. J Neurosci. 1;32(31):10767-79.
Bordji K, Becerril-Ortega J, Nicole O, Buisson A (2010). Activation of Extrasynaptic, But Not Synaptic, NMDA Receptors Modifies Amyloid Precursor Protein Expression Pattern and Increases Amyloid-? Production. J. Neurosci. 30:15927–15942
Bosson A, Boisseau S, Buisson A, Savasta M, Albrieux M (2015). Disruption of dopaminergic transmission remodels tripartite synapse morphology and astrocytic calcium activity within substantia nigra pars reticulata. Glia. 63 (4): 673–68
Membres de l'équipe
- Mireille ALBRIEUX
- Martina ALEMAN
- Sylvain ANDRIEU
- Guillaume AUDIC
- Sylvie BOISSEAU
- Eve BOREL-MENEROUD
- Alain BUISSON
- Nour CHAKROUN LAMIRI
- Yves GOLDBERG
- Samar ISMAIL
- Muriel JACQUIER-SARLIN
- Fabien LANTE
- Maximiliano MELANO
- Marie-Jo MOUTIN
- Leticia PERIS
- Apolline PIERRE
- Sacnicte RAMIREZ RIOS
- Quentin RODRIGUEZ
- Maxime SEIGNOBOS
- Aditi SHARMA
- Jean Marc SOLEILHAC
- Marion TUDURY