- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
Les microscopes simples d'utilisation
Pour un simple contrôle, ou une acquisition d'image...
Le NIKON Eclipse TS100

Microscope de contrôle pour vérifier les échantillons avant toute utilisation d'un système plus performant
Vidéomicroscopes
Les microscopes champs large sont dédiés au suivi du développement de cellules fluorescentes ou non, sur de courtes ou longues durées. Pour limiter la dégradation des échantillons observés lors de l’acquisition, un compromis doit être trouvé en favorisant des temps d’exposition courts et les changements d’illumination rapides. Certains microscopes à champs large sont équipés d'un système de régulation de température et/ou de CO2 garantissant la survie des échantillons sur de très longues durées. Les platines motorisées permettent de mémoriser plusieurs zones et de les acquérir les unes après les autres au cours d’une même expérience. Ces outils sont simples d’utilisation et répondent à la majorité des besoins. Leur limitation provient du fait de l'illumination de tout le champs d'observation qui induit un manque de résolution notamment sur les échantillons épais, ce qui peut conduire à utiliser des microscopes confocaux à balayage laser ou un spinning disk.
Services
- Observation XYZT
- Acquisitions sur de courtes ou longues durées
- Images à multi-marquages
- Thermorégulation & contrôle CO2 pour maintien des échantillons
- Multi-positionnement pour suivre plusieurs champs au cours d’une acquisition
- Échantillons fixés ou vivants
- Nombreux support d’échantillon utilisables (boite pétri, lame, boite multi-puits…)
Mode d’accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipements
- LEICA DMI6000 / ROPER
Inversé, thermorégulation, multipositions, scanslides, imagerie calcique

- ZEISS AxioObserver
Inversé, thermorégulation & contrôle CO2, multi-positions, acquisitions multiparamétriques, time lapse

- ZEISS Axiovert 200M
Microscope inversé pour observation de marquages en fluorescence.

Microscope confocal Spinning Disk
Le compromis idéal pour ceux qui recherchent la résolution et une faible phototoxicité. Le « spinning-disk » allie la rapidité du microscope champ large à la résolution d’un confocal. Cette technique utilise des lasers pour illuminer les échantillons et des caméras ultra-sensibles pour détecter le signal fluorescent. A la différence du confocal à balayage laser, le spinning disk illumine l’ensemble de la zone d’observation de manière simultanée permettant de réduire la durée d’acquisition et de réduire la photo-toxicité et permet d’accéder ainsi à l’imagerie 4D (3D + temps).
Services
- Acquisition XYZT en fluorescence et lumière blanche
- Multi-marquage
- Acquisitions sur de courtes ou longues durées
- Images à multi-marquages
- Thermorégulation & contrôle CO2 pour maintien des échantillons
- Déplacement en profondeur rapide et repositionnement précis (Platine Piezo)
- Multi-positionnement pour suivre plusieurs champs au cours d’une acquisition
- Échantillons fixés ou vivants
- Nombreux supports d’échantillon utilisables (boite pétri, lame …)
- Acquisitions Haute résolution via le module LIVE SR
Mode d’accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipements
- SPINNING DISK ZEISS Axio Observer Z1 / ROPER
Alliance d’une bonne résolution et d’une faible phototoxicité

- Module LIVE SR pour microscopie à haute résolution
Microscopes confocaux
La plateforme de microscopie photonique PIC GIN dispose de plusieurs microscopes confocaux. Ils permettre la réalisation de coupes optiques fines au sein d’un tissu/d’une cellule et capturent uniquement le signal fluorescent issu du plan focal en se débarrassant de la fluorescence parasite des plans supérieurs et inférieurs contrairement à la microscopie à champ large. Ceci donne une très bonne résolution axiale, mais les échantillons vont souffrir de la phototoxicité induite par les sources lasers diminuant la capacité d’observation au cours du temps. Les inconvénients de la microscopie confocale et la relative lenteur d'acquisition (balayage laser point par point) pouvant être contrecarré par des systèmes de type spinning disk pour les études sur le vivant.
Services
- Observation XYZT (multipositions) et dans le temps
- Images multi-marquages
- Lasers UV pour marquage nucléaires (type DAPI, Hoechst)
- Thermorégulation et contrôle CO2 pour maintien des échantillons
- Échantillons vivants ou fixés
- Analyse spectrale
- FRAP, FRET, 2D STED
- Module AIRYSCAN (haute résolution)
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipements
- ZEISS LSM900/AIRYSCAN2 (achat 2024)
Microscope inversé, analyse, spectrale, FRAP, FRET, module Airyscan2/Joint déconvolution

- ZEISS LSM710/AIRYSCAN
Microscope inversé, analyse, spectrale, thermorégulation, FRAP, FRET, module Airyscan

- LEICA TCS SPE
Microscope inversé, pas de laser UV, pas de régulation température ni CO2

- STEDYCON ABBERIOR
Microscope inversé, 4 channels pour imagerie confocale, 2DSTED possible en 2 couleurs 561nm et 640 nm, laser de déplétion 775 nm

| Images de microscopie confocale | |
|---|---|
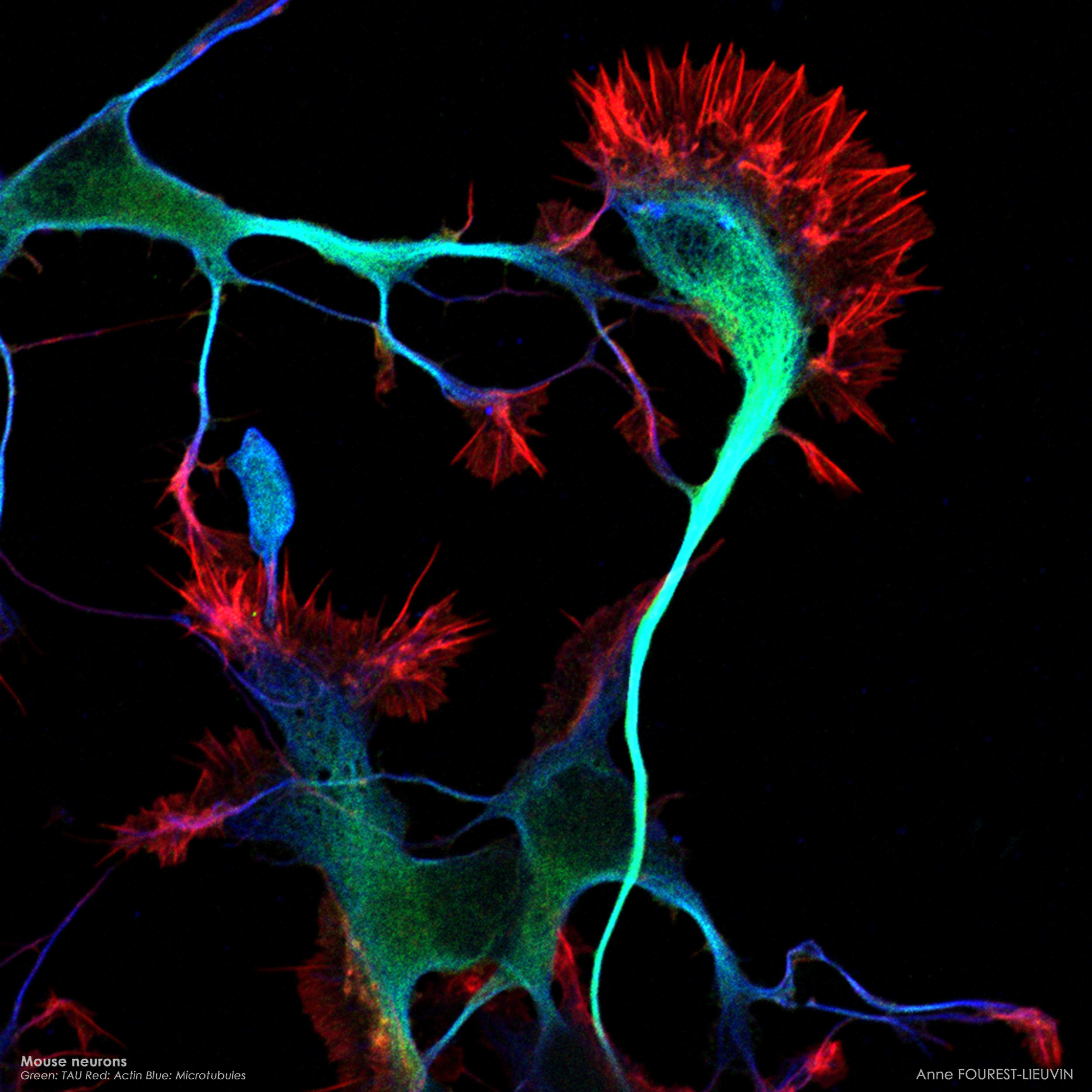
(Anne Fourest lieuvin) |
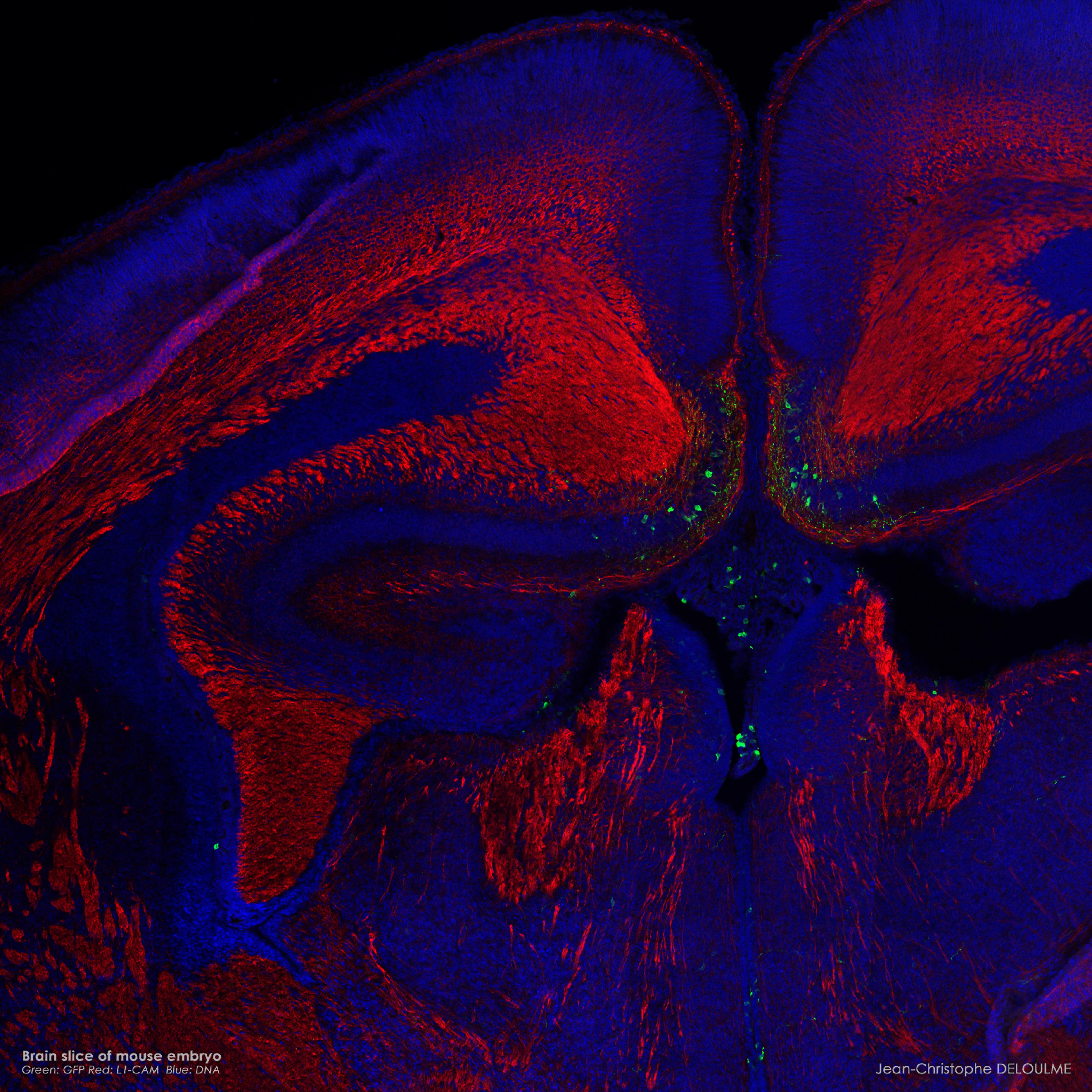
(Jean-Christophe Deloulme) |
Microscopie TIRF
La microscopie TIRF (Total Internal Reflection Fluorescence) permet d’imager une section optique d’une épaisseur de l’ordre comprise entre 20 et 200nm. En TIRF, seule la surface de l’échantillon en proximité immédiate de la lamelle est observée. La haute résolution axiale offerte par cette technique en fait un instrument de choix pour les observations membranaires ou les études du cytosquelette.
Services
- Étude de récepteurs membranaires
- Étude de l’exocytose/endocytose
- Étude de l’adhésion cellule/substrat
- Étude du cytosquelette et ses protéines associées, in Vitro
- Études de smTIRF (Single molecule)
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement
- NIKON / ROPER
Microscope inversé, thermorégulation, chauffe objectif, lasers 491 et 561nm, Optosplit II

Microscopie haute résolution
-
AIRYSCAN
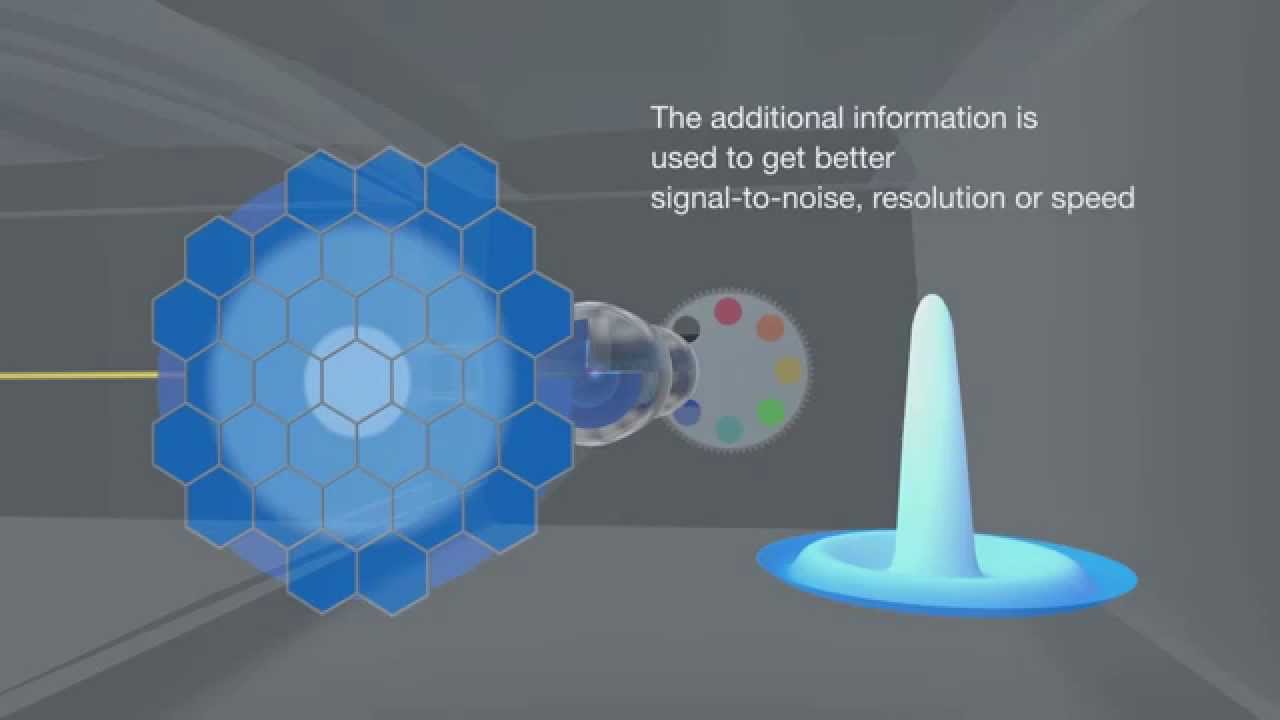
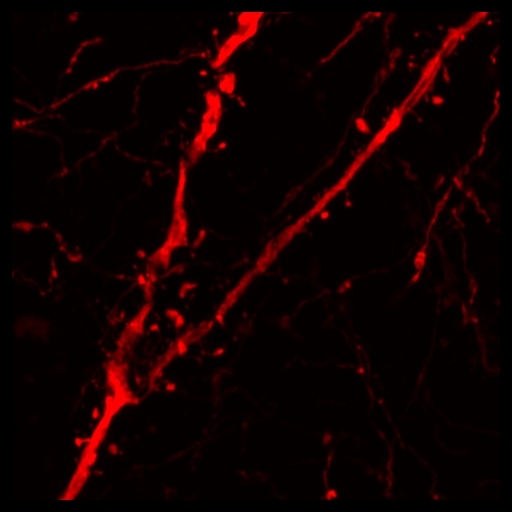
Technologie confocale pour une microscopie plus sensible et de haute résolution
Avec le détecteur AIRYSCAN installé sur le confocal LSM 710 ZEISS, les utilisateurs peuvent obtenir une résolution 1,7× plus élevée dans toutes les dimensions spatiales. Une sensibilité améliorée donne une meilleure qualité d’image. L’ensemble du processus d’imagerie peut être réalisé avec des protocoles de préparation d’échantillons et de marquages standards.
-
AIRYSCAN 2 / Joint déconvolution
L'Airyscan 2 produit plus de lumière et recueille davantage d'informations pour des résultats quantitatifs en haute résolution. Poussez la résolution encore plus loin (~90nm) en ajoutant des informations structurelles grâce à l'application de Joint Deconvolution (jDCV). Vous pouvez également utiliser les modes Multiplex pour acquérir plus rapidement des images de haute résolution.
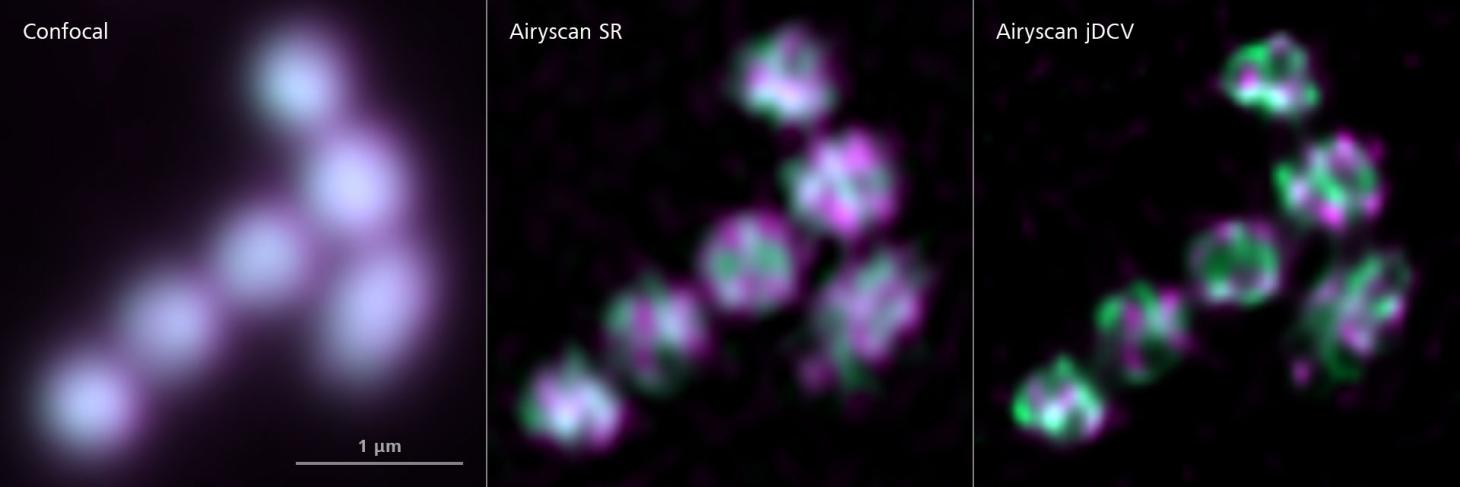
Mitochondries dans une cellule d'Arabidopsis thaliana. Comparaison de l'image confocale avec Airyscan SR et Airyscan Joint Deconvolution. J.-O. Niemeier, AG Schwarzländer, WWU Münster, Allemagne
-
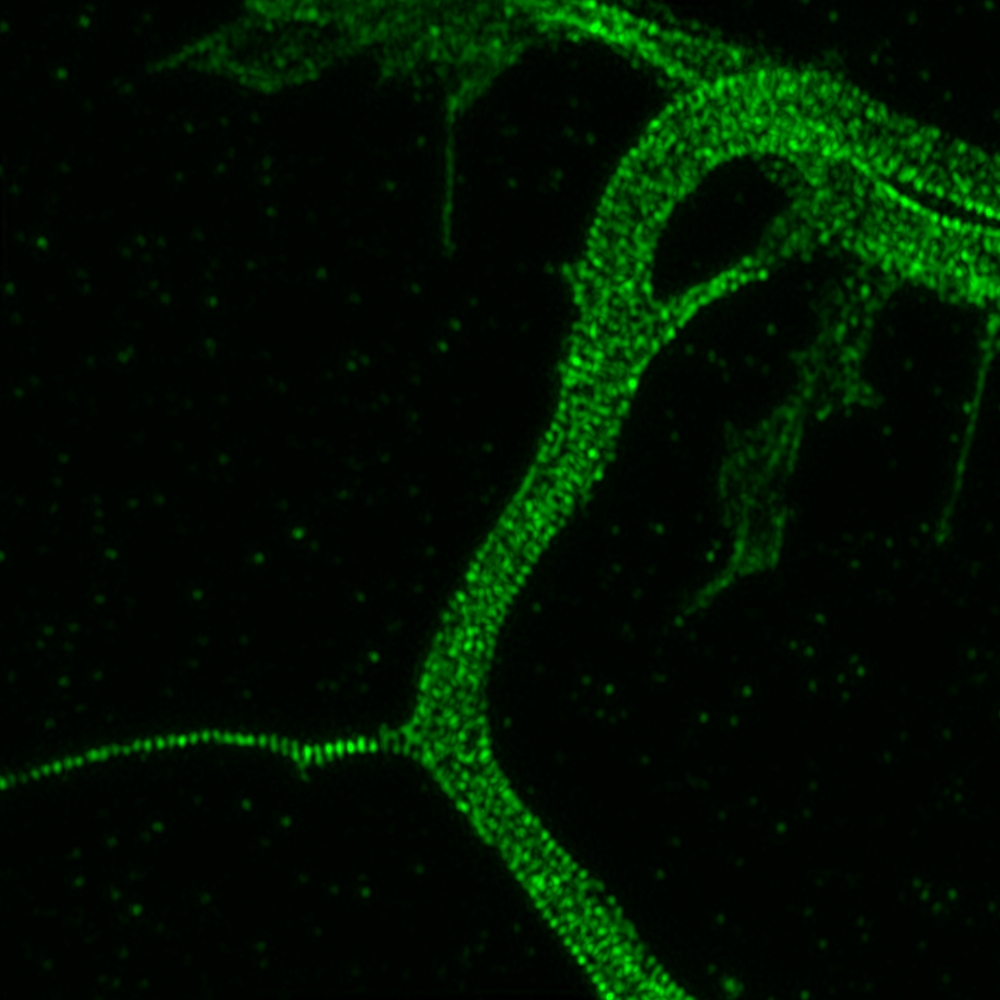
LIVE SR
Le Live-SR est une technique d'imagerie basée sur l'illumination structurée avec un traitement d'image en cours d'acquisition. Combiné au spinning disk, cela permet d'obtenir des acquisitions rapidement avec une haute résolution d'image ce qui fait du live SR la solution idéale pour l'imagerie sur cellules vivantes.

Scanner de lames
Scanner de lames équipé d'un chargeur de 100 lames. Il permet la numérisation des échantillons en lumière transmise, en polarisation et en fluorescence et la création de lames virtuelles.
Applications
- Echantillons fixés uniquement
- Immunofluorescence multimarquages, immunohistochimie (TMA, coupe de cerveau de souris, rat...), polarisation, lumière transmise
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement
- ZEISS : Axioscan Z1

Scanner de lames
Microscope à feuille de lumière
Installation du light sheet Février 2019
Ce système permet l'acquisition d'images macroscopiques en fluorescence et en 3D.
Applications
- Echantillons transparisés
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement
- LAVISION BIOTEC : Ultramacroscope II

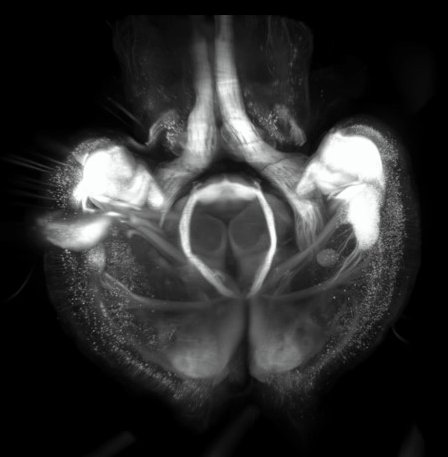
Thy1 GFP cleared Mouse Brain
Microscopie Super résolution
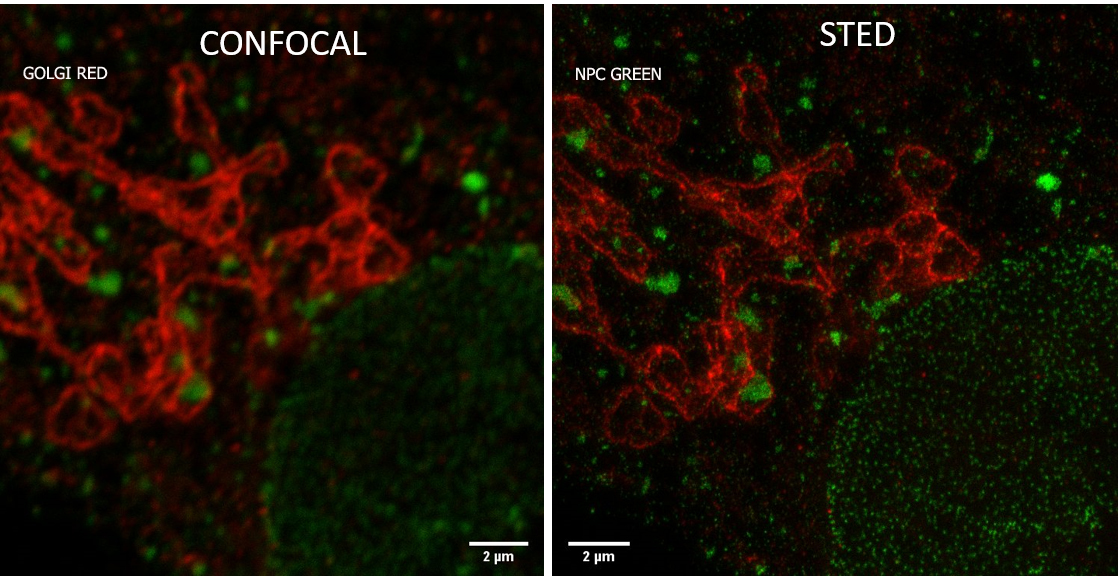
STEDYCON 2D
Avec le nouveau module STEDYCON (Abberior) installé sur un microscope à épifluorescence conventionnelle (Zeiss), les utilisateurs auront accès à un nouveau microscope confocal et à la microscopie superrésolution STED 2D. Ce module STEDYCON permet d'obtenir une résolution ~60nm dépendante du fluorochrome et de l'objectif utilisé
Applications
- Acquisitions confocales XYZ en fluorescence (4 longueurs d'ondes possibles)
- Multi-marquage
- Déplacement en profondeur rapide et repositionnement précis (Piezo placé sur objectif)
- Échantillons fixés seulement
- Support d’échantillon utilisables (boite pétri, lame …)
- Acquisition en Super résolution 2D STED possibles pour 2 longueurs d'ondes
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement
- STEDYCON: Abberior


Microscopie Stéréologie
La stéréologie est une méthode pour l'histologie quantitative qui permet de quantifier directement sous microscope et avec précision le nombre de cellules, la longueur des fibres, ainsi que la surface et le volume des structures ou régions biologiques.
Applications
- Acquisitions et analyses quantitative d'images en transmission
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement : MBF
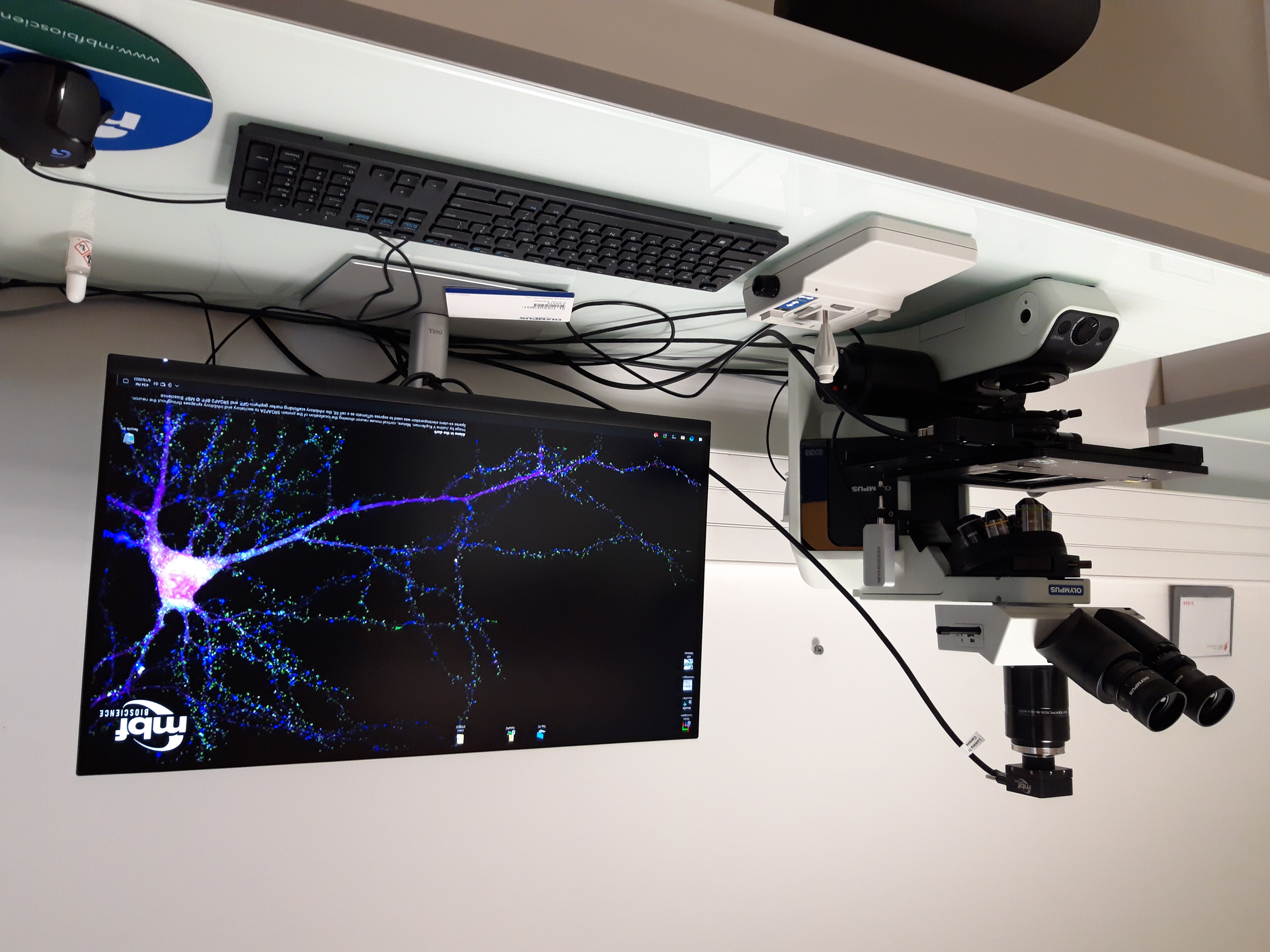
- Microscope : BX 53 Olympus droit
•Objectifs : x2, x10, x20, x40, x60, x100
•Caméra : couleur
•Logiciel : StereoInvestigator
Salle informatique
Une salle informatique est à disposition des utilisateurs de la plateforme pour le transfert des données des utilisateurs extérieurs et le traitement des images.
Mode d'accès
- Assistance
- Autonomie (après formation)
- Prestation de service sur demande
Equipement
- Logiciels IMARIS, Zen Blue, MetaMorph, Fiji installés sur PC
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn