- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
Communiqué / Eq I.Arnal et A.Andrieux
Le 27 mai 2024
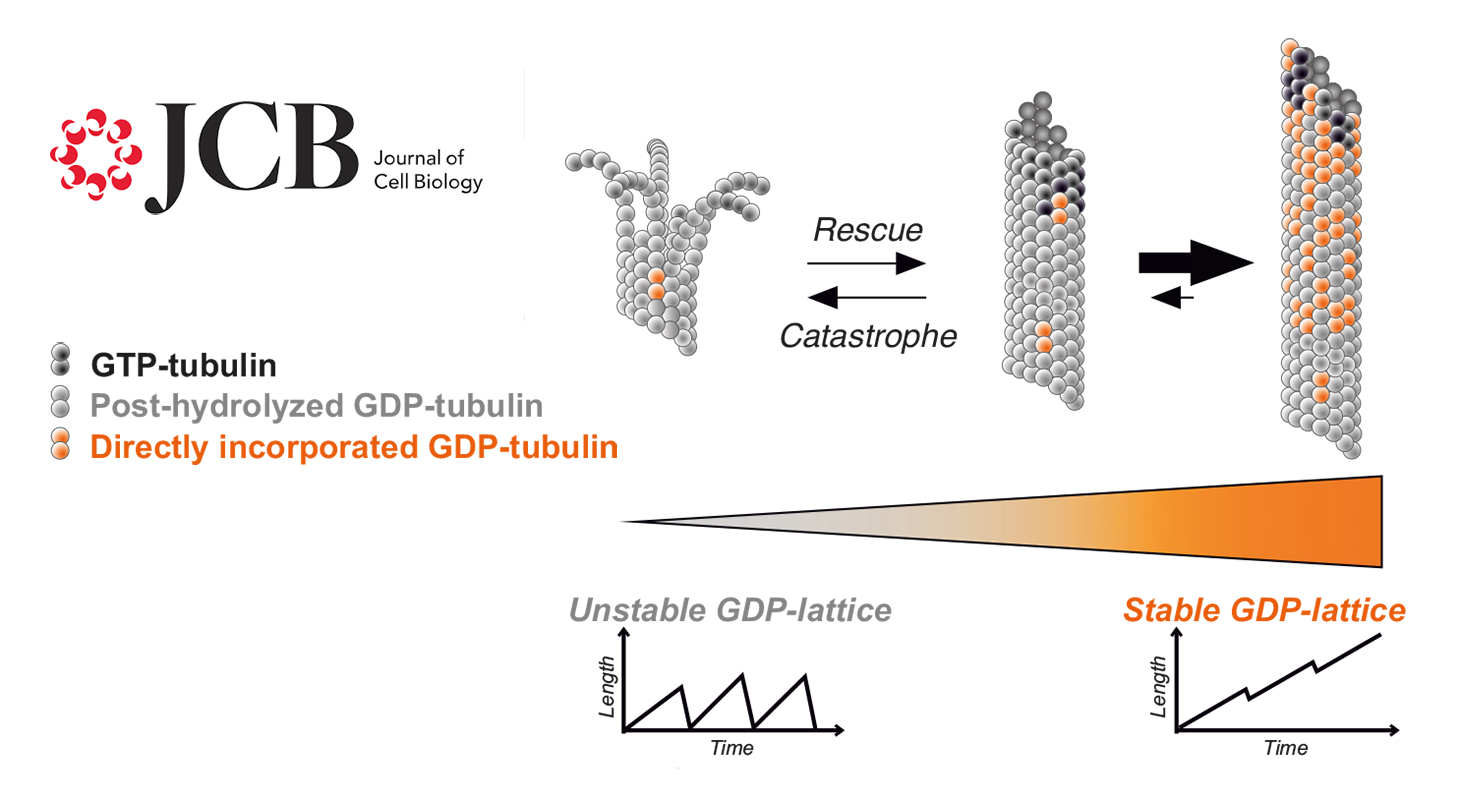
Des chercheurs du GIN apportent une nouvelle compréhension de l’instabilité dynamique des microtubules.
La tubuline liée au GDP, à ce jour considérée comme inactive dans la formation des microtubules, peut en réalité polymériser en microtubules étonnamment stables. Ces travaux viennent d’être publiés dans la revue scientifique Journal of Cell Biology.
L'intérieur des cellules est traversé par un réseau de fibres formant une véritable structure squelettique, appelée cytosquelette. Ce cytosquelette joue un rôle crucial dans des fonctions essentielles comme le transport intracellulaire, le maintien de la forme cellulaire et la division des cellules.
Contrairement au squelette osseux, le cytosquelette est dynamique, ce qui signifie qu'il peut se réorganiser rapidement en réponse aux besoins de la cellule. Cette situation crée une demande contradictoire : le cytosquelette doit être assez stable pour remplir ses fonctions, tout en étant suffisamment flexible pour se réorganiser en de nouveaux réseaux lorsque nécessaire. Ainsi, le contrôle de la dynamique du cytosquelette est essentiel au bon fonctionnement des cellules.
Les microtubules sont un composant majeur du cytosquelette. Ce sont des tubes creux de 25 nm de diamètre et longs de quelques micromètres, qui forment des « rails » nécessaires au transport intracellulaire. Les microtubules résultent de l’assemblage d’une protéine dimérique, la tubuline, qui s’insère aux extrémités du tube. L’assemblage et le désassemblage des microtubules est régi par l’hydrolyse d’une petite molécule, le GTP, associé à la tubuline.
Le modèle actuel de la dynamique des microtubules stipule qu’un microtubule s’allonge par l’incorporation de tubuline liée au GTP à son extrémité. Une fois incorporée, la tubuline hydrolyse le GTP en GDP, libérant ainsi de l’énergie qui est stockée dans le microtubule, le rendant instable. Plus le nombre de molécule de tubuline incorporées augmente, plus l’énergie accumulée est grande, jusqu’à ce que le microtubule devienne si instable qu’il dépolymérise soudainement. Les molécules de tubuline-GDP libérées dans le cytoplasme échangent alors le GDP contre du GTP et redeviennent ainsi compétentes pour réincorporer un microtubule. Ce cycle perpétuel d’assemblage et de désassemblage, couplé à l’hydrolyse du GTP, confère aux microtubules leur caractéristique d’instabilité dynamique.
Dans le modèle qui vient d’être décrit, la tubuline-GDP est considérée comme inactive dans la formation des microtubules. Cependant, l’équipe "Dynamique et Structure du Cytosquelette Neuronal" dirigée par Isabelle Arnal et Annie Andrieux du GIN a montré que la tubuline-GDP est en réalité capable de former des microtubules. Ces microtubules possèdent des propriétés uniques : ils sont remarquablement stables et ne se désassemblent pas spontanément.
Ces travaux montrent que les microtubules possèdent une capacité intrinsèque de stabilité, indépendante de protéines accessoires. Ces microtubules stables pourraient jouer un rôle crucial dans les cellules différenciées comme les neurones, où une stabilité accrue du réseau microtubulaire est essentielle à leur bon fonctionnement. Un autre exemple est la régénération des axones après une lésion qui requiert une balance appropriée entre des populations de microtubules dynamiques et stables.
Référence :
Stable GDP-tubulin islands rescue dynamic microtubules.
Nassiba Bagdadi, Juliette Wu, Julie Delaroche, Laurence Serre, Christian Delphin, Manon De Andrade, Marion Carcel, Homaira Nawabi, Benoît Pinson, Claire Vérin, Yohann Couté, Sylvie Gory-Fauré, Annie Andrieux*, Virginie Stoppin-Mellet* and Isabelle Arnal*.
J Cell Biol (2024) 223 (8): e202307074. doi.org/10.1083/jcb.202307074
Date
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn