- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn
Communiqué / Eq J.Bastin, Parkinson
Le 21 mai 2025
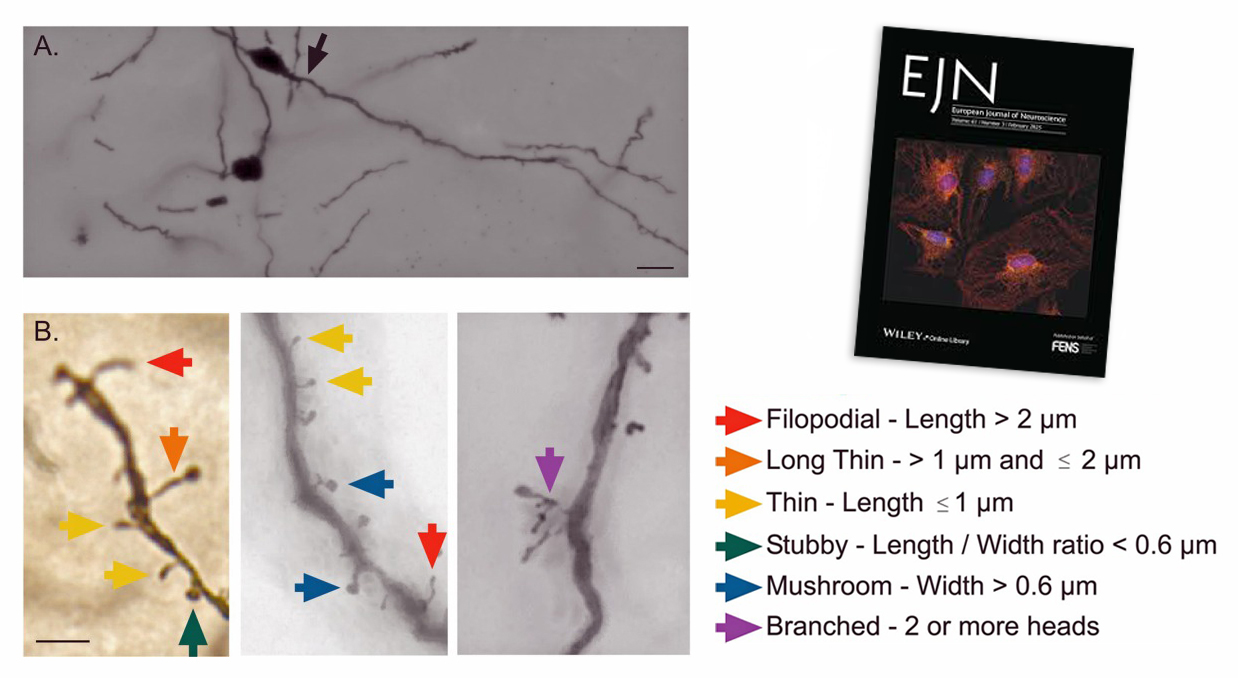
L’impact de la maladie de Parkinson sur le tronc cérébral a jusqu’ici été peu étudié. Pourtant, des chercheurs du GIN viennent de montrer chez des rats parkinsoniens, que certaines de ses structures sont capables de se réorganiser, apportant la preuve d’une neuroplasticité spécifique.
La maladie de Parkinson est une maladie neurodégénérative caractérisée par une perte progressive des neurones dopaminergiques. Suite à cette perte, les neurones GABAergiques dans la substantia nigra pars reticulata, une structure de sortie des ganglions de la base, deviennent hyperactifs.
« Notre hypothèse était donc que la libération accrue de GABA par ces neurones devait induire des neuroadaptations dans les structures du tronc cérébral les recevant notamment le colliculus supérieur (latéral et médian) et la substance grise périaqueducale » explique Véronique Coizet, chercheure au GIN dans l’équipe "Cerveau, Comportement et Neuromodulation" et autrice de la publication. « L'objectif de cette étude était d'évaluer la plasticité cellulaire et moléculaire dans ces structures, chez des rats atteints de la maladie de Parkinson ayant subi une lésion dopaminergique partielle ou totale. »
Au niveau anatomique, les neuroscientifiques ont utilisé la méthode de Golgi-Cox pour mesurer la densité et la morphologie des épines dendritiques. Au niveau moléculaire, ils se sont servis de la technique du Western blot pour analyser l'expression des récepteurs GABA de type A.
Leurs résultats montrent une augmentation de la densité des épines dendritiques « Thin » et « stubby » dans le colliculus et la substance grise périaqueducale mais uniquement dans le cas de lésions dopaminergiques totales. Cependant, l’augmentation de l’expression des récepteurs GABA de type A n’a été observée que dans le colliculus latéral et dans le groupe ayant subi une lésion dopaminergique totale.
« On observe finalement des différences de plasticité dans ces structures du tronc cérébral qui suggèrent l'existence de mécanismes compensatoires dans la Maladie Parkinson, qui peuvent retarder son apparition et contribuer aux symptômes moteurs et non moteurs chez le patient » conclut Véronique Coizet.
D'autres études devraient être menées pour comprendre pleinement l'impact fonctionnel de la plasticité révélée dans ces travaux.
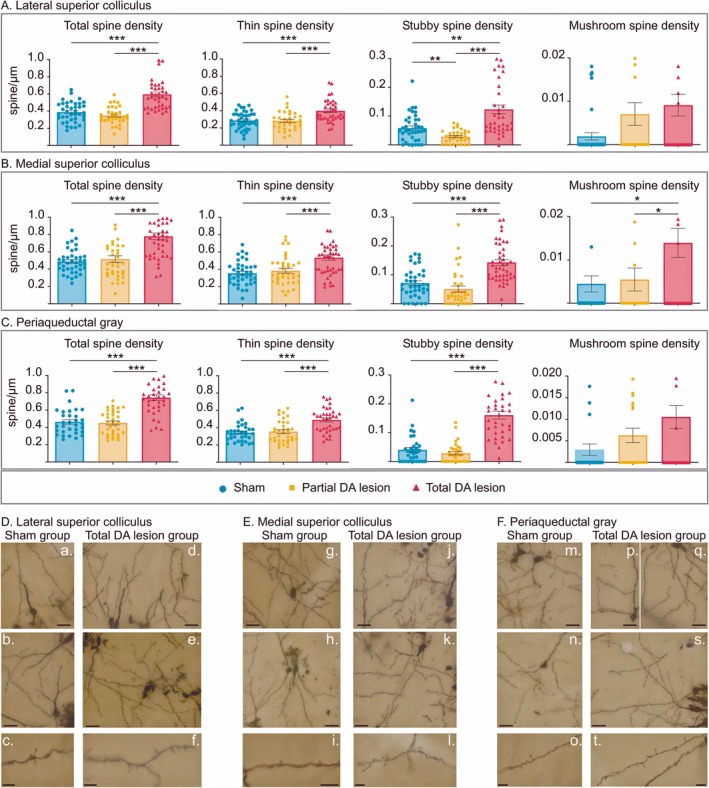
Top panel: histograms (mean ± SEM) of the total spine, thin spine, stubby spine, and mushroom spine density measured in tissue labeled with Golgi–Cox staining in the sham (blue), partial (orange), and total (red) DA lesion groups within the lateral superior colliculus (A), the medial superior colliculus (B), and the periaqueductal gray (C). Bottom panel: photomicrograph montages (merge of different Z axes) of dendritic spines labeled with Golgi–Cox staining in the lateral superior colliculus (D), the medial superior colliculus (E), and the periaqueductal gray (F) in the sham (a–c, g–i, m–o) and total DA lesion groups (d–f, j–l, p, q, s, t). Scale bar = 20 μm (top and middle pictures). Scale bar = 5 μm (bottom pictures). *p < 0.05, **p < 0.01, and ***p < 0.001.
Référence :
Brainstem Neuroadaptations in Rodent Models of Parkinson's Disease
Racha Al Tannir , Arnaud Pautrat , Remi Soutrenon , Paul G Overton , Veronique Coizet
Eur J Neurosci. 2025 Mar 31;61(7):e70068. doi: 10.1111/ejn.70068
Date
- Imprimer
- Partager
- Partager sur Facebook
- Partager sur X
- Partager sur LinkedIn